

INTRODUCCIÓN El campo especifico de la química no ha sido ajeno a la necesidad de un lenguaje químico unificado, que permita identificar las formulas y nombres de las sustancias independientemente del lugar donde se utilicen.
La Unión Internacional de Química Pura y Aplicada –IUPAC- ha establecido normas para nombrar y escribir tanto los compuestos orgánicos como los inorgánicos.
En la actualidad se manejan tres tipos de nomenclatura: la establecida por la IUPAC, llamada funcional o sistemática; la STOCK, en honor al químico Alemán Alfred Stock, que ha tenido gran aceptación por su sencillez, y la nomenclatura tradicional, la cual cada día se usa menos.
La nomenclatura sistemática y stock conforman un tipo de nomenclatura moderna y está orientada a dar, a los compuestos, nombres más acordes con la formulade la sustancia.
La química inorgánica incluye la materia no viviente, como los metales, los no metales y las diversas combinaciones entre dichos elementos.
La química inorgánica incluye los compuestos del carbono, es decir, las sustancias que contienen carbono y provienen de los seres vivos o también aquellos compuestos similares que se obtienen por síntesis en el laboratorio.
Los compuestos inorgánicos se agrupan según la forma en que se combinan, lo cual determina su comportamiento y características similares. Cada agrupación de dichos compuestos se conoce con el nombre de función química.
Las funciones químicas presentan un átomo o un grupo de átomos que las diferencian entre sí. Dichas funciones, para la química inorgánica, son cuatro: oxido, hidróxido, acido y sal.
Para escribir la formula de los óxidos, ácidos y sales se acostumbra poner los símbolos de los elementos que los componen en orden, según su electronegatividad: el menos electronegativo a la izquierda y el más electronegativo a la derecha, por ejemplo, CaSO4, BaO. Otro criterio ha sido escribir a la izquierda el ion positivo o catión y, a la derecha, el anión o ion negativo por ejemplo: Na+Cl-; Cu+NO-3.

valencia
Es la capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos. La valencia es un número, positivo o negativo, que nos indica el número de electrones que gana, pierde o comparte un átomo con otro átomo o átomos.
VALENCIAS DE LOS ELEMENTOS MÁS IMPORTANTES DEL SISTEMA PERIÓDICO.
NO METALES
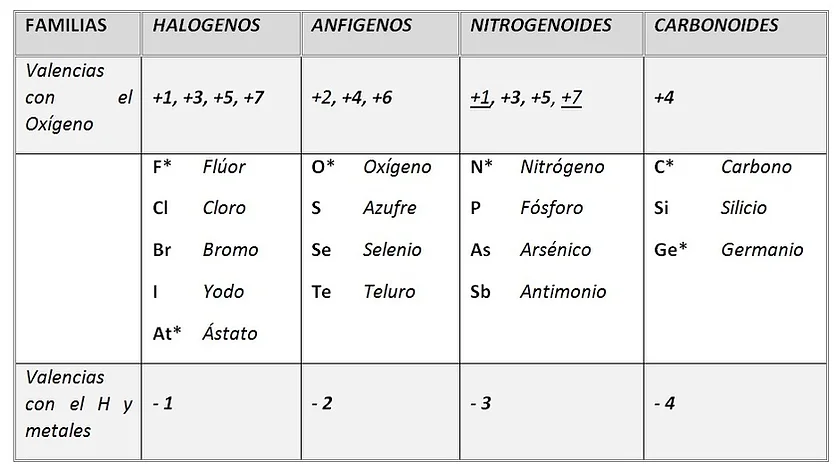
F* únicamente con -1
At * no forma compuestos, por ser inestable
O * funciona únicamente con -2
N * el nitrógeno funciona también con +2 y +4
C* funciona también con +2
Ge * elemento anfótero: actúa como metal y no metal
+1 y +7 valencias de los nitrogenoides no muy usuales
Metales



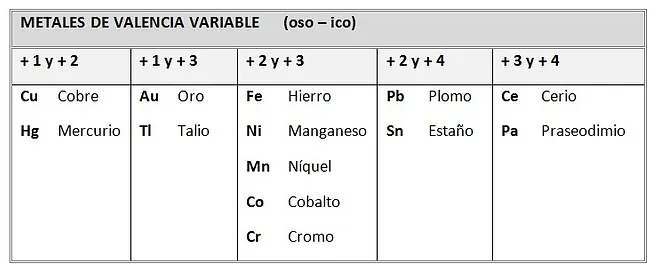
3-5
Nb
V
Ta
NOMENCLATURAS
Para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC (Unión Internacional de Química Pura y Aplicada). Se aceptan tres tipos de nomenclaturas para los compuestos inorgánicos:
- Nomenclatura sistemática.
- Nomenclatura de stock, y
- La Nomenclatura tradicional.
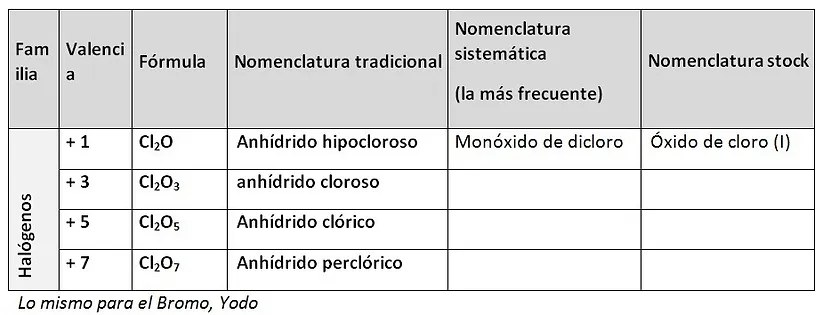
a) NOMENCLATURA SISTEMÁTICA
Para nombrar compuestos químicos según esta nomenclatura se utilizan los prefijos: MONO_, DI_, TRI_, TETRA_, PENTA_, HEXA_, HEPTA_, etc. Ejemplo:
Cl2O3 Trióxido de dicloro
I2O Monóxido de diyodo
b) NOMENCLATURA DE STOCK
En este tipo de nomenclatura, cuando el elemento que forma el compuesto tiene más de una valencia (valencia variable), ésta se indica al final, en números romanos y entre paréntesis:
Fe(OH)2 Hidróxido de hierro (II)
Fe(OH)3 Hidróxido de hierro (III)
c) NOMENCLATURA TRADICIONAL
En esta nomenclatura para poder distinguir con qué valencia funcionan los elementos en ese compuesto se utilizan una serie de prefijos y sufijos:

COMPUESTOS BINARIOS
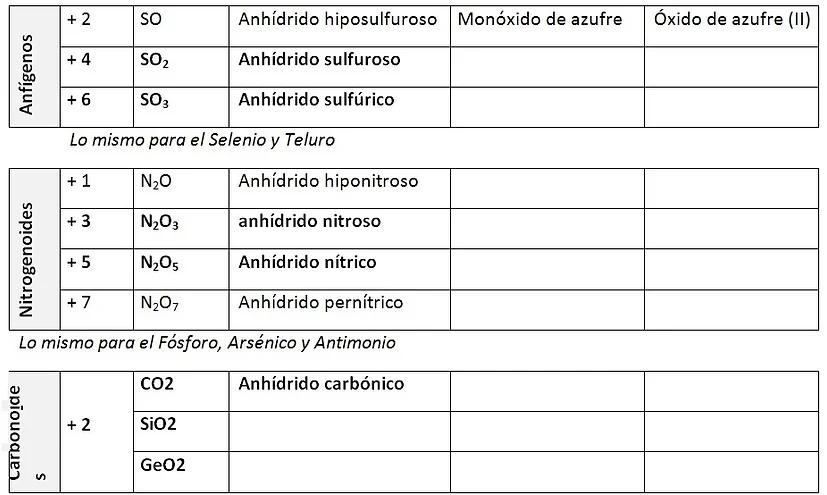
a) ANHÍDRIDOS (ÓXIDOS ÁCIDOS)
Son compuestos inorgánicos binarios oxigenados y no hidrogenados, formados por la combinación de un no metal con el oxígeno.
- Formación: NO METAL + OXIGENO --------> ANHÍDRIDO
LAS VALENCIAS DE LOS ELEMENTOS SE INTERCAMBIAN ENTRE ELLOS Y SE PONEN COMO SUBÍNDICES. (Si la valencia es par se simplifica). Ejemplos:
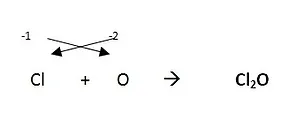

Nomenclatura:
El nombre Genérico: es la palabra “Anhídrido”.
El nombre específico: es el nombre del no metal con prefijos y sufijos (hipo_oso, _oso, _ico, per_ico).
ACTIVIDAD CLASE
b) ÓXIDOS METALICOS (OXIDOS BASICOS)
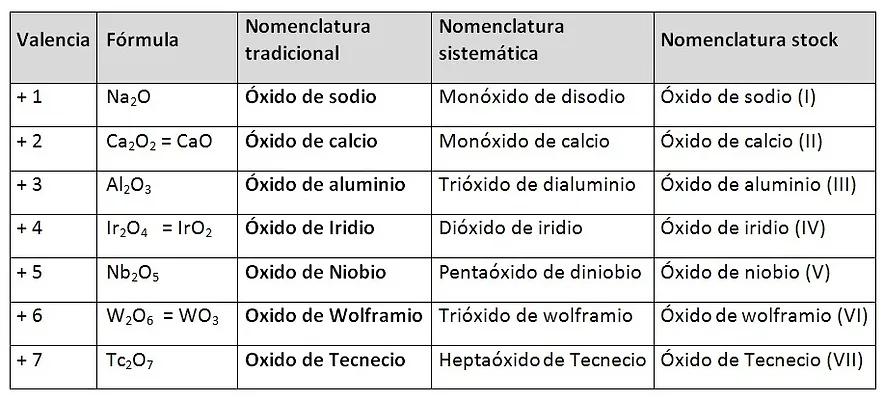
Son compuestos binarios oxigenados y no hidrogenados, formados por la combinación de un metal y el oxígeno.
- Formación: METAL + OXIGENO --------> ÓXIDO METÁLICO
LAS VALENCIAS DE LOS ELEMENTOS SE INTERCAMBIAN ENTRE ELLOS Y SE PONEN COMO SUBÍNDICES. (Si la valencia es par se simplifica).
- Nomenclatura:
El nombre Genérico: es la palabra “Oxido”.
El nombre específico: es el nombre del no metal, si el metal es de valencia variable su nombre terminará en oso o en ico con la menor y mayor valencia respectivamente.
ACTIVIDAD EN CLASE

No hay comentarios:
Publicar un comentario